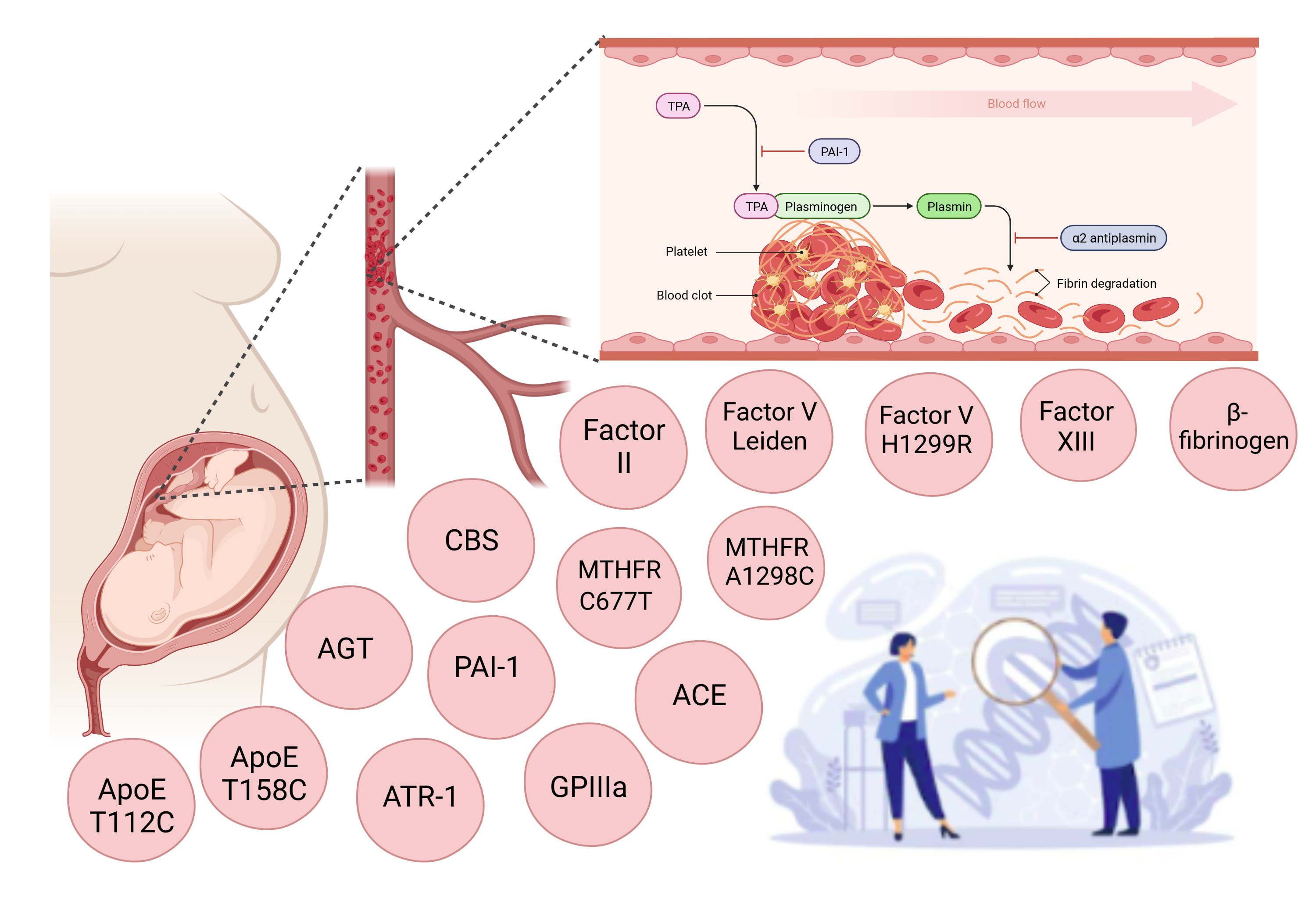
CE ESTE TROMBOFILIA?
Trombofilia descrie o condiție în care sângele prezintă o tendință crescută de coagulare. Este cauzată de o predispoziție genetică, de factori dobândiți sau ambele. În cazul femeilor, trombofilia moștenită, nedectată și fără tratament, poate duce la pierderi recurente de sarcină sau complicații moderate-severe.
În termeni generali, coagularea este procesul prin care este oprită sângerarea în cazul leziunilor de la suprafața pielii. Însă, în cazul persoanelor care suferă de trombolfie, se pot forma cheaguri de sânge care pot conduce la complicații, în special în perioada sarcinii.
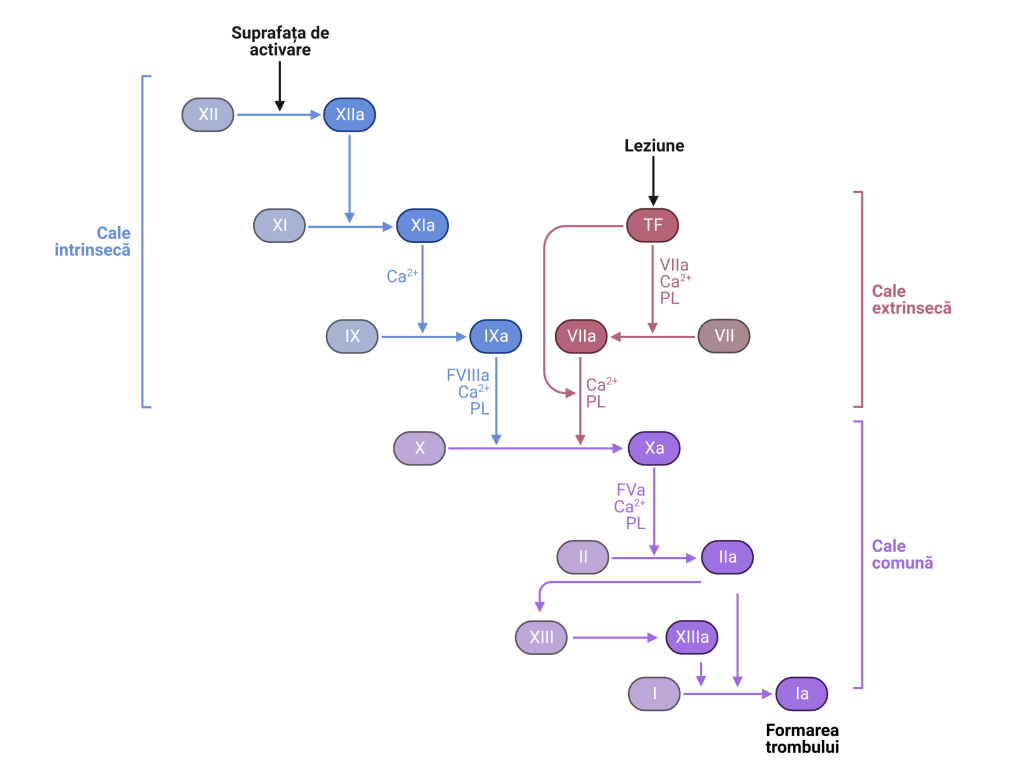
Trombofilia ereditară cea mai frecventă este cea cauzată de mutații care afectează cascada de coagulare, o serie complexă de reacții chimice între factori care au rolul de a coagula sângele. Cele mai comune sunt mutația genei pentru factorul de coagulare V (FV), urmată de cea cauzată de mutația genei pentru factorul de coagulare II (FII).
Trombofilia dobândită poate fi cauzată de o varietate de factori, inclusiv terapie hormonală, sarcină,
obezitate, cancer, boli autoimune sau anumite medicamente. Toți acești factori pot conduce la un
risc crescut de coagulare, fiind alterată balanța dintre factorii de coagulare și cei anti-coagulare.
Persoanele cu trombofilie prezintă un risc ridicat de aparitie a cheagurilor la nivelul venelor profunde de
la picior (tromboza venoasă) sau la plămâni (embolism pulmonar).
Tratamentul poate include utilizarea unei medicații anti-coagulante pentru a preveni formarea coagularea.
Trombofilia poate crește riscul de complicații pe durata sarcinii. Femeile însărcinate au un risc crescut de a dezvolta cheaguri la nivelul picioarelor, pelvisului sau plamânilor.
CAUZE
Există mai multe cauze ale trombofiliei, unele fiind de natură genetică, iar altele fiind legate de stilul de viață și factori de risc.
Cauzele comune ale trombofiliei includ:
- Factori genetici: Anumite mutații genetice, cum ar fi mutația Factor V Leiden sau mutația G20210A a genei protrombinei, pot crește riscul de trombofilie. Alte afecțiuni genetice rare pot, de asemenea, să
crească riscul de coagulare a sângelui. - Stil de viață: Factori precum fumatul, obezitatea, sedentarismul sau consumul excesiv de alcool
pot crește riscul de trombofilie. - Afecțiuni medicale: Anumite afecțiuni medicale pot crește riscul de trombofilie, cum ar fi cancerul, insuficiența cardiacă, boala arterială periferică, lupusul eritematos sistemic sau sindromul
antifosfolipidic. - Medicamente: Unele medicamente, cum ar fi contraceptivele orale sau terapia hormonală de substituție, pot crește riscul de trombofilie.
Este important să discutați cu medicul dumneavoastră despre orice factori de risc pentru trombofilie și să fiți atenți la semnele și simptomele acestei afecțiuni.
CAUZE GENETICE
Factor V
Cunoscut și sub deumirea de proaccelerin, este o proteină care joacă un rol important in procesul de
coagulare a sângelui. Este produs în ficat și circulă prin sânge ca un precursor inactiv, numit profactor V. În momentul rănirii unui vas sanguin, o serie complexă de reacții chimice este antrenată să conducă la formarea cheagului pentru a opri sângerearea. Factorul V este activat în timpul acestui proces și ajută la convertirea protrombinei în trombină, care este enzima cheie implicată in formarea cheagului.
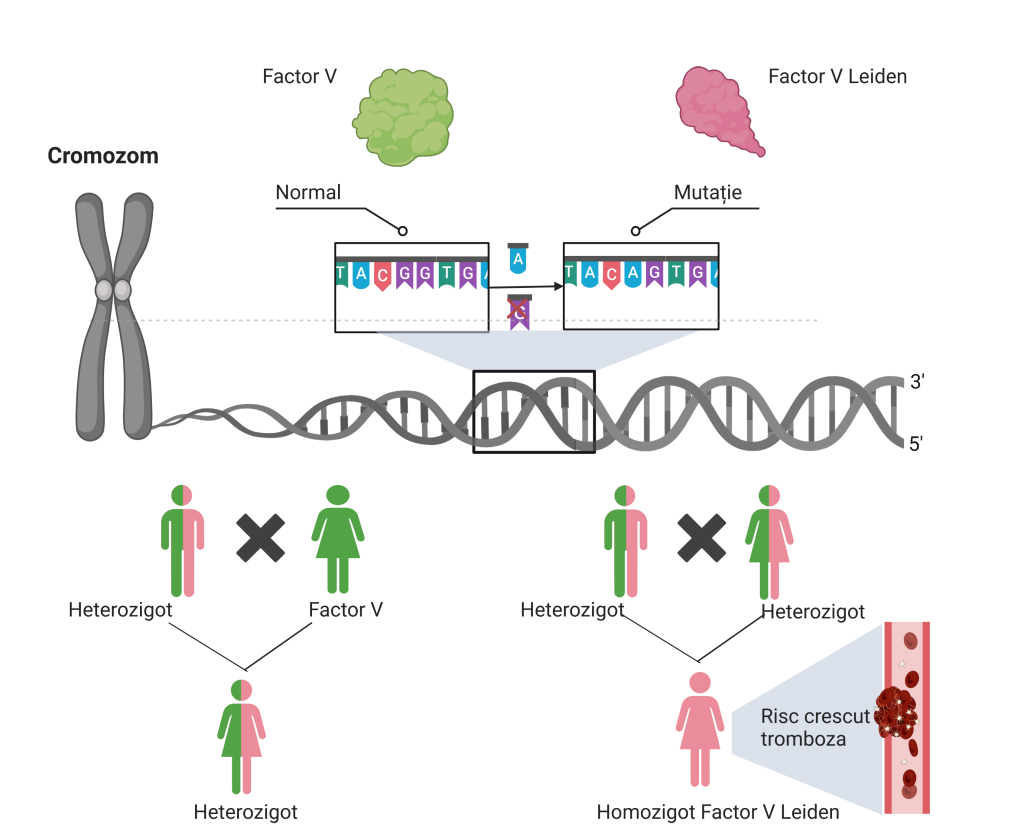
O parte din persoane pot moșteni o mutație în gena pentru Factor V, cunoscut ca și Factor V Leiden, care rezultă întro formă modificată a factorului V, rezistent la inactivarea de către anticoagulantul natural numit proteina C activă. Acest fapt aduce la un risc crescut de a dezvolta cheaguri anormale, cum ar fi tromboza venoasa profundă (TVP) sau embolism pulmonar.
Factor V Leiden este cea mai comună mutație moștenită pentru trombofilie si se estimează că 5%
din populația generală este purtătoare a acestei mutații.
Există mai multe studii care au investigat asocierea dintre mutația FV Leiden și complicațiile sale, inclusiv în sarcină. Un studiu publicat în revista American Journal of Obstetrics and Gynecology în 2018 a analizat datele a 2.038 de femei gravide și a constatat că femeile care au avut mutația FV Leiden aveau un risc mai mare de a dezvolta preeclampsie, tromboză venoasă profundă și tromboembolism pulmonar decât femeile care nu au avut această mutație. Un alt studiu publicat în revista Thrombosis Research în 2019 a evaluat asocierea dintre mutația FV Leiden și avortul recurent. Studiul a inclus 200 de femei cu antecedente de avorturi spontane repetate și 200 de femei sănătoase ca grup de control. Autorii au constatat că frecvența mutației FV Leiden a fost semnificativ mai mare în grupul de femei cu avorturi recurente decât în grupul control.
În general, cercetările sugerează că mutația FV Leiden poate fi asociată cu un risc crescut de complicații în timpul sarcinii, inclusiv preeclampsie, tromboză venoasă profundă, tromboembolism pulmonar și avort recurent.
Mutația H1299R a factorului V este similară cu Factor V Leiden, însa mai putin comună. Este considerată o cauză rară de trombofilie. În acest caz, rezultă un Factor V modificat, prin înlocuirea unuui aminoacid histidină într-un aminoacid arginină la poziția 1299.
Factor II
Cunoscut sub denumirea de protrombină, este o proteină care are un rol crucial în procesul de coagulare a sângelui. E produs în ficat și circulă în sânge sub forma unui precursor inactiv, numit protrombin. Procesul de activare este similar cu cazul factorului V și ajută la convertirea fibrinogenului în fibrină, care formează baza structurală a cheagului. Cea mai comună mutație este G20210A, care rezultă într-un nivel crescut de protrombină în sânge și risc ridicat de a avea cheaguri anormale. În general, cercetările sugerează că mutația protrombinei G20210A poate fi asociată cu un risc crescut de complicații în timpul sarcinii, inclusiv TVP, preeclampsie, retard de creștere intrauterină și naștere prematură.
Un studiu publicat în revista American Journal of Obstetrics and Gynecology a evaluat riscul de TVP în timpul sarcinii și în perioada de la naștere până la 12 săptămâni postpartum la femeile cu mutația protrombinei G20210A și a constatat că acestea prezintă un risc crescut de TVP în aceste perioade.
Un alt studiu publicat în European Journal of Obstetrics & Gynecology and Reproductive Biology a
examinat asocierea dintre mutația protrombinei G20210A și complicațiile sarcinii și a constatat că
aceasta poate crește riscul de preeclampsie, retard de creștere intrauterină și naștere prematură.
Factor XIII
Este o enzimă implicată în procesul de coagulare a sângelui. Polimorfismul V34L al genei care
codifică subunitatea A a FXIII (FXIII-A) a fost asociat cu diverse afecțiuni, inclusiv cu complicații
obstetricale. În ceea ce privește sarcina, au fost efectuate câteva studii care au examinat asocierea
dintre polimorfismul V34L al FXIII-A și diverse probleme, inclusiv avort spontan, preeclampsie și
naștere prematură.
Un studiu publicat în revista Clinical and Applied Thrombosis/Hemostasis în 2021 a investigat
asocierea dintre polimorfismul V34L al FXIII-A și riscul de preeclampsie într-o populație turcă.
Cercetătorii au constatat că frecvența genotipului VV (homozigot pentru alela V) a fost semnificativ
mai mare la femeile cu preeclampsie decât la femeile sănătoase, sugerând că alela V poate fi un
factor de risc pentru preeclampsie.
Un alt studiu publicat în revista European Journal of Obstetrics, Gynecology, and Reproductive
Biology în 2020 a examinat asocierea dintre polimorfismul V34L al FXIII-A și nașterea prematură
într-o populație românească. Studiul a inclus 62 de femei cu naștere prematură și 81 de femei cu
naștere la termen ca grup de control. Nu a fost identificata însă, nicio asociere semnificativă între
polimorfismul V34L al FXIII-A și nașterea prematură.
β-fibrinogen
Polimorfismul beta-fibrinogen 455G>A (cunoscut și ca polimorfismul -455 G/A sau rs1800790)
este o variație genetică a genei beta-fibrinogenului care a fost studiată în legătură cu sarcina.
Fibrinogenul este o proteină plasmatică care joacă un rol crucial în coagularea sângelui.
Polimorfismul beta-fibrinogen 455G>A a fost asociat cu modificări ale nivelurilor de fibrinogen,
alela A fiind asociată cu niveluri mai mari de fibrinogen decât alela G. Mai multe studii au
investigat asocierea dintre polimorfismul beta-fibrinogen 455G>A și posibile probelem ale sarcinii,
cum ar fi preeclampsia, restricția creșterii fetale și nașterea prematură. Cu toate acestea, rezultatele
acestor studii au fost inconsecvente, unele studii raportând o asociere semnificativă între
polimorfism și reacțiile adverse ale sarcinii, în timp ce altele nu au găsit nicio asociere.
O meta-analiză publicată în 2013 a analizat rezultatele a 27 de studii privind asocierea dintre
polimorfismul beta-fibrinogen 455G>A și preeclampsie, identificând o asociere semnificativă între
alela A și riscul crescut de preeclampsie, în special la populațiile asiatice. Cu toate acestea,
cercetatorii au remarcat că dovezile generale au fost limitate de dimensiunile mici ale eșantionului
și de eterogenitatea studiilor incluse.
Un studiu recent în Journal of Thrombosis and Thrombolysis în 2020 a investigat asocierea dintre
polimorfismul β-fibrinogen 455G>A și riscul de tromboembolism venos recurent (TEV) la pacienții
tratați cu terapie anticoagulantă. Studiul rezultat că alela A a fost asociată cu un risc crescut de TEV
recurent.Un alt studiu publicat în Journal of Obstetrics and Gynecology Research în 2021 a investigat
asocierea dintre polimorfismul β-fibrinogen 455G>A și riscul de diabet gestațional (GDM) la o
populație chineză, descoperind că cele cu genotipul AA aveau un risc mai mare de a dezvolta GDM
decât cele cu genotipul GG.
MTHFR
Se referă la metilentetrahidrofolat reductază, o enzimă implicată într-un proces numit metilare.
Metilarea este un proces biochimic care joacă un rol critic în multe funcții importante din organism inclusiv sinteza și repararea ADN-ului, sinteza neurotransmițătorilor și detoxifiere. Mutațiile MTHFR au fost legate de un risc crescut de trombofilie, mai exact, varianta C677T a genei MTHFR a fost asociată cu un risc crescut de tromboză venoasă profundă (TVP) și embolie pulmonară (EP).
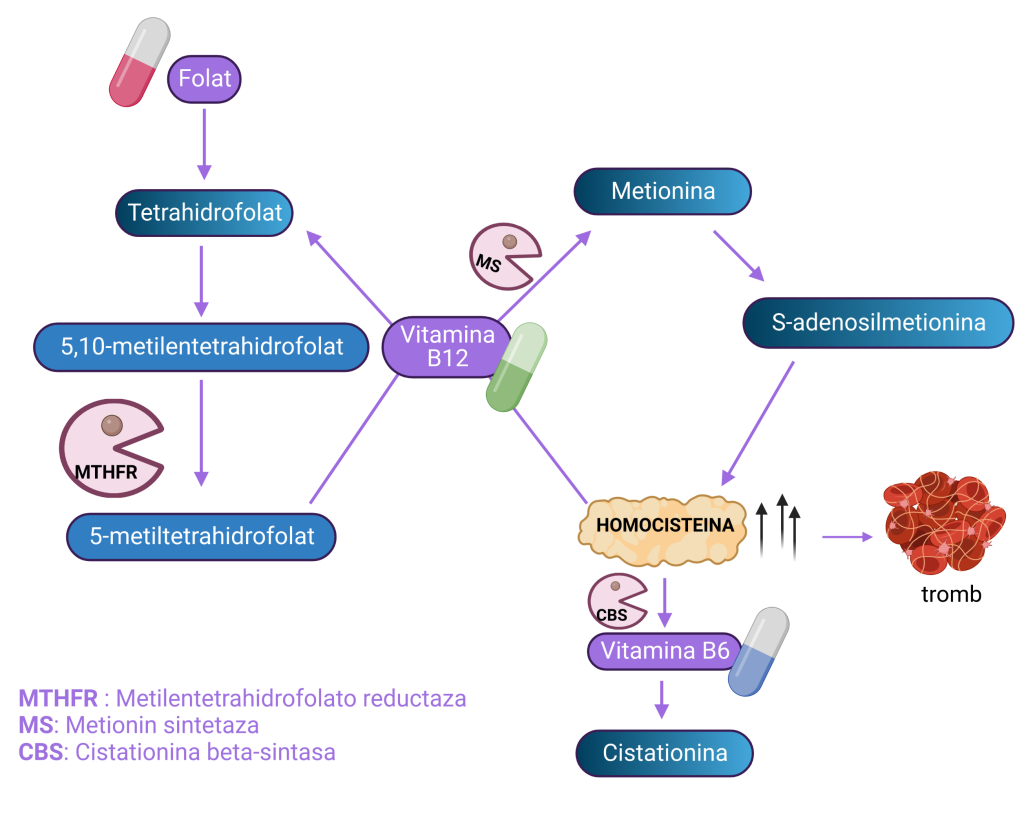
Mecanismul exact prin care mutațiile MTHFR cresc riscul de trombofilie nu este pe deplin înțeles, dar se pare că este legat de scăderea nivelului de folați și de metabolismul afectat al homocisteinei. Homocisteina este un aminoacid care este metabolizat de organism, iar nivelurile ridicate de homocisteină din sânge au fost asociate cu un risc crescut de boli cardiovasculare și tromboză.
Mutațiile MTHFR pot duce la scăderea activității enzimei MTHFR, care afectează conversia homocisteinei în metionină. Acest lucru poate duce la niveluri crescute de homocisteină în sânge, care crește riscul de trombofilie prin promovarea coagulării sângelui și afectarea funcției mucoasei interioare a vaselor de sânge.
Mutațiile genei MTHFR sunt frecvente și pot afecta funcția enzimei MTHFR, ducând la scăderea
capacității de metilare. Unele dintre cele mai frecvente mutații MTHFR includ variantele C677T și
A1298C.
Cu toate acestea, este important de menționat că relația dintre mutațiile MTHFR și aceste condiții de sănătate este complexă și nu toți indivizii cu mutații MTHFR vor dezvolta aceste afecțiuni. În plus, alți factori genetici și de mediu pot contribui, de asemenea, la riscul general pentru sănătatea unui individ. Prin urmare, testarea genetică pentru mutațiile MTHFR ar trebui interpretată în contextul sănătății generale și al istoricului familial al unui individ.
Cele mai recente studii privind MTHFR, s-au focusat pe o varietate de subiecte, inclusiv:
- complicațiii în timpul sarcinii: Câteva studii sugereaza că variantele MTHFR pot crește riscul de
complicații, cum ar fi avorturile recurente, preeclampsia și defecte ale tubului neural. - boli neurologice și psihiatrice: Este un interes tot mai mare în potențialul rol pe care îl are
MTHFR în dezvoltarea bolilor neurologice si psihiatrice, cum ar fi depresia, bipoliritatea și boala
Alzheimer. Câteva studii au identificat asocieri între acest econdiții și variante ale genei MTHFR. - boli caridovasculare: mutatii MTHFR au fost asociate cu un risc crescut de boli cardiovasculare,
datorită efectelor de la nivelul homocisteinei.
CBS (cystathionine beta-synthase)
Este o enzimă implicată în conversia homocisteinei în cisteină. Similar genei MTHFR, mutații la nivelul acestei gene, pot duce la schimbări în metabolismul homocisteinei și creșterea riscului de apariție a unor probleme de sănătate precum: dizabilitate intelectuală, tromboembolism, boli cardiovasculare. Pentru a funcționa corect, CBS are nevoie de vitamina B6 ca și cofactor. Deficiența de CBS poate fi tratată cu o dietă redusă în metionine și suplimente de B6.
Aditional, CBS este implicată și în procese celulare, inclusiv producția de sulf de hidrogen (un gazotransmițător cu potențiale efecte cardioprotectoare) și reglarea echilibrului redox celular. Câteva studii au arătat ca mutațiile CBS sunt asociate cu un risc crescut de trombofilie. De exemplu, un studiu publicat în Journal of Thrombosis and Haemostasis a identificat că anumite mutații CBS erau mai frecvente la femeile cu trombofilie pe perioada sarcinii, decât la pacienții control.
PAI-1 (inhibitorul activatorului de plasminogen-1)
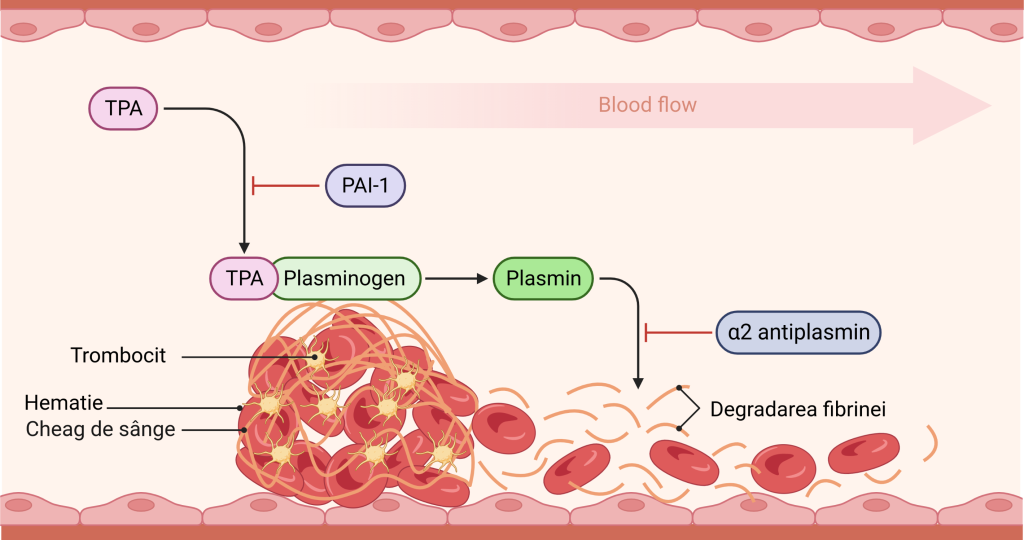
Este o proteină care joacă un rol important în reglarea coagulării sângelui și a fibrinolizei (descompunerea cheagurilor de sânge). PAI-1 este produs de diferite celule din organism, inclusiv celule endoteliale, trombocite și adipocite.
În timpul sarcinii, nivelul PAI-1 crește treptat pe măsură ce sarcina progresează. Acesta este considerat a fi un răspuns fiziologic normal care ajută la prevenirea sângerării excesive în timpul nașterii. Cu toate acestea, nivelurile crescute de PAI-1 au fost, de asemenea, asociate cu mai multe rezultate adverse ale sarcinii, inclusiv preeclampsie, diabet gestațional și restricție de creștere fetală.
La femeile cu antecedente de avort spontan recurent sau infertilitate, au fost observate niveluri crescute de PAI-1. Unele studii au sugerat că tratamentul cu anticoagulante, cum ar fi heparina cu greutate moleculară mică, poate îmbunătăți rezultatele sarcinii la aceste femei. Cu toate acestea, sunt necesare mai multe cercetări pentru a stabili siguranța și eficacitatea acestor intervenții. În general, relația dintre PAI-1 și sarcină este complexă și nu este încă pe deplin înțeleasă. Este probabil influențată de o serie de factori genetici, de mediu și de stil de viață.
Studii recente de meta-analiză au identificat că persoanele cu alela 4G au un risc mai mare de tromboembolism venos în comparație cu cei cu alela 5G, iar nivelurile crescute de PAI-1 au fost
asociate cu un risc crescut de trombofilie.
Enzima de conversie a angiotensinei (ACE)
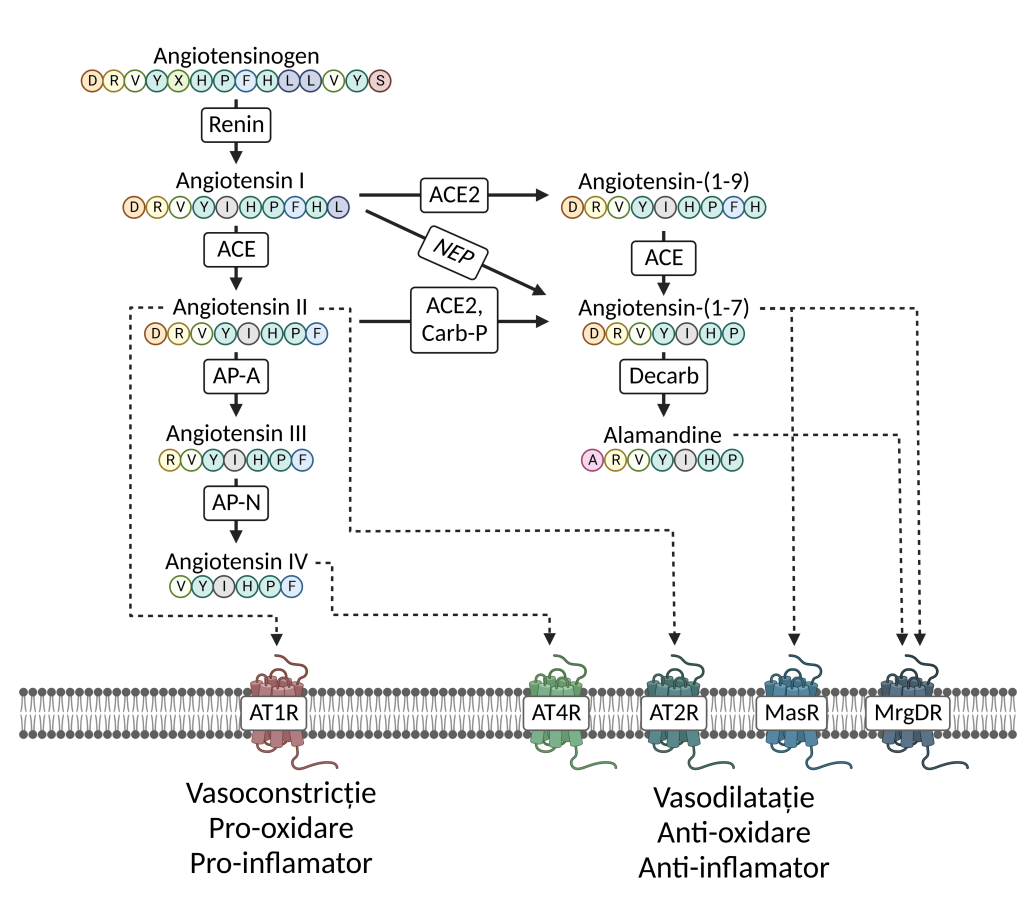
Există dovezi limitate care leagă polimorfismul de inserție/deleție (I/D) al enzimei de conversie a
angiotensinei (ACE) cu trombofilia. Cu toate acestea, unele studii au sugerat o posibilă asociere
între polimorfismul ACE I/D și un risc crescut de tromboembolism venos (TEV).
De exemplu, o meta-analiză a lui Wu et al. (2014) a descoperit că persoanele cu genotipul ACE DD
aveau un risc semnificativ mai mare de TEV în comparație cu cei cu genotipul II sau ID. O altă meta-analiză a lui Kolev și colab. (2017) a raportat, de asemenea, o asociere semnificativă între polimorfismul ACE I/D și riscul de TEV, deși dimensiunea efectului a fost redusă.
Se consideră că polimorfismul ACE I/D poate influența riscul TEV prin efectele sale asupra
sistemului renină-angiotensină-aldosteron, care joacă un rol în reglarea tensiunii arteriale și homeostazia vasculară. Cu toate acestea, mecanismele precise care stau la baza acestei asocieri nu sunt bine înțelese și sunt necesare cercetări suplimentare pentru a clarifica relația dintre polimorfismul ACE I/D și trombofilie.
ATR-1
Gena ATR-1 A1166C (cunoscută și ca AGTR1) codifică receptorul angiotensinei II de tip 1, care joacă un rol important în reglarea tensiunii arteriale și a echilibrului fluidelor. Au existat mai multe studii care investighează asocierea dintre polimorfismul ATR-1 A1166C și posibile probeleme ale sarcinii, în special preeclampsia și hipertensiunea gestațională.
Un studiu publicat în revista Pregnancy Hypertension în 2020 a investigat asocierea dintre polimorfismul ATR-1 A1166C și riscul de preeclampsie la o populație chineză, identificând că alela C este asociată cu un risc crescut de preeclampsie.
Un alt studiu publicat în Journal of Obstetrics and Gynecology Research în 2020 a investigat asocierea dintre polimorfismul ATR-1 A1166C și hipertensiunea gestațională la o populație chineză și a concluzionat că alela C a fost asociată cu un risc crescut de hipertensiune gestațională.
Un studiu publicat în Journal of the American Society of Hypertension în 2021 a investigat asocierea dintre polimorfismul ATR-1 A1166C și tensiunea arterială maternă în timpul sarcinii la o populație braziliană și au observat că alela C este asociată cu o tensiune arterială sistolică și diastolică mai mare în al treilea trimestru.
AGT
Gena AGT M235T (cunoscută și ca AGT Met235Thr) codifică angiotensinogenul, care este o
proteină precursoare pentru angiotensina II, un regulator cheie al tensiunii arteriale și al echilibrului
fluidelor. Mai multe studii au investigat asocierea dintre polimorfismul AGT M235T și efectele
asupra sarcinii. Un studiu publicat în revista Pregnancy Hypertension în 2021 a investigat asocierea
dintre polimorfismul AGT M235T și riscul de preeclampsie la o populație chineză și au identificat
că există o asociație între alela T și risc crescut de preeclampsie. Un alt studiu publicat în Journal of
Clinical Hypertension în 2021 a investigat asocierea dintre polimorfismul AGT M235T și
hipertensiunea gestațională la o populație chineză, identificând asociere între alela T și un risc
crescut de hipertensiune gestațională.
Un studiu publicat în Journal of the American Society of Hypertension în 2021 a investigat
asocierea dintre polimorfismul AGT M235T și tensiunea arterială maternă în timpul sarcinii la o
populație braziliană, idetificând asociere între alela T și tensiune arterială sistolică mai mare în al
treilea trimestru.
GPIIIa
GPIIIa (cunoscută și ca integrină alfa-IIb beta-3) este o proteină transmembranară care formează un heterodimer cu proteina GPIIb, care împreună formează integrina trombocitară alfa-IIb beta-3. Acest complex este receptorul major pentru fibrinogen, o proteină implicată în coagularea sângelui.
Pe lângă rolul său în agregarea trombocitelor și formarea cheagurilor, GPIIIa este implicată și în alte procese celulare, cum ar fi adeziunea și migrarea celulelor. Mutațiile genei GPIIIa pot provoca o tulburare genetică rară numită trombastenie Glanzmann, care se caracterizează prin afectarea funcției trombocitelor și tendința de a sângera. Medicamentele antiplachetare, cum ar fi aspirina și clopidogrelul, vizează complexul GPIIb/IIIa pentru a preveni agregarea trombocitară și formarea cheagurilor de sânge. Aceste medicamente sunt uneori utilizate pentru prevenirea sau tratarea evenimentelor cardiovasculare, cum ar fi atacurile de cord și accidentele vasculare cerebrale.
Polimorfismele GPIIIa au fost studiate și în legătură cu alte boli, cum ar fi cancerul și tulburările autoimune, dar dovezile sunt încă limitate și contradictorii. GPIIIa este exprimată nu numai pe trombocite, ci și pe alte tipuri de celule, inclusiv celule endoteliale, celule musculare netede și anumite tipuri de celule imunitare. Funcția GPIIIa în aceste celule nu este pe deplin înțeleasă și necesită cercetări suplimentare.
ApoE (apolipoprotein E)
Este o proteină implicată în transportul lipidelor și metabolismul acestora în organism. Există trei
tipuri principale de alele ApoE (ε2, ε3 și ε4), iar polimorfismul T112C și T158C se referă la variații
ale genelor care codifică aceste alele. Polimorfismul T112C se referă la o variație a genei care
codifică alela ε4, în timp ce polimorfismul T158C se referă la o variație a genei care codifică alela
ε2.
Există puține studii care au examinat asocierea dintre polimorfismul T112C și T158C ale ApoE și
complicațiile obstetricale. Cu toate acestea, un studiu publicat în revista PLOS ONE în 2015 a
examinat asocierea dintre aceste polimorfisme ale ApoE și preeclampsia. Studiul a inclus 165 de
femei cu preeclampsie și 253 de femei sănătoase ca grup de control. Autorii au constatat că femeile
cu polimorfismul T112C al alelei ε4 aveau un risc semnificativ mai mare de a dezvolta
preeclampsie decât femeile care nu aveau acest polimorfism. În schimb, nu au găsit nicio asociere
semnificativă între polimorfismul T158C al alelei ε2 și preeclampsie.
SIMPTOME
Multe persoane cu trombofilie nu prezintă simptome și pot să nu-și dea seama că au această afecțiune. Cu toate acestea, în cazurile severe, trombofilia poate provoca cheaguri de sânge care pot bloca fluxul de sânge către organe sau țesuturi și pot cauza simptome.
Simptomele comune ale trombozei venoase profunde (DVT) pot include:
- Inflamare la nivelul unui singur picioar, în special la nivelul gleznei sau a gambelor
- Durere sau senzație de furnicături în picior, care poate fi mai intensă în timpul mersului
- Căldură sau roșeață în zona afectată
Simptomele emboliei pulmonare (PE), care este o complicație a DVT, pot include: - Durere toracică bruscă sau senzație de presiune în piept
- Respirație dificilă sau rapidă
- Tuse cu sânge sau spută sângeroasă
- Transpirație excesivă
- Palpitatii sau o senzație de bătăi puternice ale inimii
- Leșin sau amețeli.
Dacă oricare dintre aceste simptome sunt prezente, este important consultul unui medic.
DIAGNOSTIC
Diagnosticul de trombofilie poate implica o combinație de istoric medical, examene fizice și teste de laborator.
Unele dintre etapele comune de diagnostic includ:
- Istoric medical: Medicul poate întreba despre simptomele dumneavoastră, istoricul medical și de familie, utilizarea medicamentelor și factorii de risc pentru tromboză.
- Examen fizic: Medicul poate efectua un examen fizic pentru a verifica semne de inflamare, roșeață sau căldură la nivelul picioarelor, precum și pentru a verifica tensiunea arterială și frecvența cardiacă.
- Teste de laborator: Mai multe teste de laborator pot fi utilizate pentru a diagnostica trombofilia, cum ar fi măsurarea proteinelor C, S și antitrombinei III, factorul V Leiden, mutația G20210A a genei protrombinei, printre altele. Aceste teste pot ajuta la identificarea modificărilor genetice care cresc riscul de formare a cheagurilor.
- Examinări imagistice: În unele cazuri, examenele de imagistică, cum ar fi ecografia sau rezonanța magnetică, pot fi utilizate pentru a detecta prezența cheagurilor de sânge în vene.Diagnosticul de trombofilie este important pentru a ajuta la prevenirea complicatiilor grave, cum ar fi embolia pulmonara sau accidentul vascular cerebral.
GENETIC LAB pune la dispoziție un panel de 15 mutații, care include cele mai frecvente mutații
prezente în trombofilie
TRATAMENT
Dacă o femeie însărcinată are un istoric de tromboză sau a fost diagnosticată cu trombofilie, este necesar sa fie monitoziată atent pe perioada sarcinii, deoarece este posibil să aiba nevoie de tratament cu heparină sau low-molecular weight heparinaă pentru a reduce riscul de coagulare.
Tipul de trombofilie și severitatea vor determina strategia de tratament. Femeile cu istoric de avorturi recurente pot primi aspirină sau heparină pe parcursul sarcinii pentru a reduce riscul de coagulare.
Un studiu recent publicat in New England Journal of Medicine in 2019 a descoperit un nou medicament anticoagulant oral numit edoxaban este la fel de efectiv precum heparina injectabilă in prevenirea tromboembolismului venos recurent la pacienții cu tromboză asociată cancerului.
Aceasta este o descoperire semnificativă, deoarece mulți pacienți cu cancer și tromboză au probleme in managerierea zilnică a injecțiilor și poate fi benefică medeicația orala.
Alt studiu publicat in Journal of Trombosis and Haemostasis in 2020 a descoperit că femeile cu trombofilie care au utilizat contraceptive hormonale au avut un risc crescut de tromboză, în special dacă au avut factori adiționali precum fumatul sau obezitatea. Studiul reflecta importanța considerării riscurilor și beneficiilor contraceptivelor hormonale în cazul femeilor cu trombofilie.
BIBLIOGRAFIE
- Bennett, J. S. (2005). Platelet-fibrinogen interactions. Annals of the New York Academy of Sciences, 936, 340-354. https://doi.org/10.1111/j.1749-6632.2001.tb03526.x
- Cox, D., & Thomas, M. L. (2013). GPIIb-IIIa inhibitors in cardiovascular disease. Current pharmaceutical design, 19(21), 3858-3867. https://doi.org/10.2174/1381612811319210002
- Nurden, A. T. (2014). Glanzmann thrombasthenia. Orphanet Journal of Rare Diseases, 9(1), 1-11. https://doi.org/10.1186/1750-1172-9-1
- Ortega-Recalde, O., & López-Maderuelo, D. (2017). Platelet glycoprotein IIIa polymorphisms in relation to cancer susceptibility and treatment response. Expert Opinion on Drug Metabolism & Toxicology, 13(1), 59-70. https://doi.org/10.1080/17425255.2016.1259961
- Woulfe, D. S. (2010). Platelet G protein-coupled receptors in hemostasis and thrombosis. Journal of thrombosis and haemostasis: JTH, 8(3), 453-463. https://doi.org/10.1111/j.1538-7836.2009.03656.x
- Kondkar, A. A., Al-Suliman, A. M., Al Balawi, I. A., Al Shamrani, S. M., Al-Mashat, F. M., & Al-Momen, A. M. (2020). The β-fibrinogen 455G>A polymorphism and risk of recurrent venous thromboembolism in anticoagulant-treated patients. Journal of Thrombosis and Thrombolysis, 49(4), 582-588. doi: 10.1007/s11239-020-02103-x
- Lu, W., Wei, X., Liu, J., & Wang, X. (2021). Association of β-fibrinogen gene 455G/A polymorphism with gestational diabetes mellitus in a Chinese population. Journal of Obstetrics and Gynaecology Research, 47(8), 2552-2560. doi: 10.1111/jog.14766
- Chen, J., Li, L., Qin, X., Wang, Y., Yang, H., Ma, X., & He, F. (2020). Association between the angiotensin II type 1 receptor A1166C polymorphism and risk of preeclampsia in a Chinese population. Pregnancy Hypertension, 22, 66-72. doi: 10.1016/j.preghy.2020.08.007
- Li, Y., Li, X., Zhang, H., Wang, Y., & Zhao, L. (2020). Association between the angiotensin II type 1 receptor A1166C polymorphism and gestational hypertension in a Chinese population. Journal of Obstetrics and Gynaecology Research, 46(11), 2308-2315. doi: 10.1111/jog.14413
- de Oliveira, I. S., Souza, A. F., de Fátima Sales, M., Costa, E. C., & de Oliveira, C. M. (2021). Association of AGTR1 gene polymorphisms with maternal blood pressure during pregnancy. Journal of the American Society of Hypertension, 15(6), 459-467. doi: 10.1016/j.jash.2021.02.009
- Yang, X., Chen, Y., Liu, F., & Zhou, Y. (2021). Association between the angiotensinogen M235T polymorphism and preeclampsia risk in a Chinese population. Pregnancy Hypertension, 26, 101-106. doi: 10.1016/j.preghy.2021.07.007
- Zhang, Q., Chen, Y., Wang, X., & Liao, Y. (2021). Association between the angiotensinogen M235T polymorphism and gestational hypertension in a Chinese population. Journal of Clinical Hypertension, 23(7), 1415-1421. doi: 10.1111/jch.14214
- de Oliveira, I. S., Souza, A. F., de Fátima Sales, M., Costa, E. C., & de Oliveira, C. M. (2021). Association of AGT gene polymorphisms with maternal blood pressure during pregnancy. Journal of the American Society of Hypertension, 15(9), 817-825. doi: 10.1016/j.jash.2021.06.012
- Gokkaya, E., & Yenicesu, I. (2021). Factor XIII-A V34L Polymorphism and Preeclampsia: A Case-Control Study. Clinical and Applied Thrombosis/Hemostasis, 27, 10760296211014044. doi: 10.1177/10760296211014044
- Stoian, V., Luca, C., Iancu, A. D., & Toma, N. (2020). Factor XIII A-subunit V34L polymorphism and preterm birth risk in a Romanian population. European Journal of Obstetrics, Gynecology, and Reproductive Biology, 249, 86-89. doi: 10.1016/j.ejogrb.2020.04.050
- Wang, L., Liu, Y., Zhang, W., Zhang, X., Qi, H., & Wang, H. (2015). Association of apolipoprotein E polymorphisms with preeclampsia in Chinese Han women. PLOS ONE, 10(4), e0124614. doi: 10.1371/journal.pone.0124614
- Thaler, B., Hohensinner, P. J., Krychtiuk, K. A., Wojta, J., & Huber, K. (2018). The role of factor V Leiden in pregnancy complications. American Journal of Obstetrics and Gynecology, 218(2), 126-134. doi: 10.1016/j.ajog.2017.09.017
- Gungor, T., Kanat-Pektas, M., & Mollamahmutoglu, L. (2019). Association of factor V Leiden mutation with recurrent pregnancy loss: A case-control study. Thrombosis Research, 181, 81-85. doi: 10.1016/j.thromres.2019.08.004
- Martinelli I, Taioli E, Battaglioli T, et al. Risk of venous thromboembolism after air travel: interaction with thrombophilia and oral contraceptives. Arch Intern Med. 2003;163(22):2771-2774.
- Simioni P, Sanson BJ, Prandoni P, et al. Incidence of venous thromboembolism in families with inherited thrombophilia. Thromb Haemost. 1999;81(2):198-202.
- Salomon O, Steinberg DM, Zivelin A, et al. Single and combined prothrombotic factors in patients with idiopathic venous thromboembolism: prevalence and risk assessment. Arterioscler Thromb Vasc Biol. 1999;19(3):511-518.
- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 197: Inherited thrombophilias in pregnancy. Obstet Gynecol. 2018;132(3):e18-e34. doi:10.1097/AOG.0000000000002873